Contamination des eaux de baignade et des coquillages par des matières fécales : comment identifier les sources

Certains de ces micro-organismes peuvent être pathogènes pour l’Homme et donc rendre malades, non seulement, des baigneurs mais aussi les consommateurs de coquillages. En effet, les bivalves — huîtres, moules ou palourdes — se nourrissent de plancton : ils filtrent et concentrent ainsi les bactéries et les virus présents dans les eaux.
La majorité de ces micro-organismes pathogènes sont d’origine fécale. Ils sont issus du tube digestif de l’Homme et des animaux, à l’image des salmonelles, des Campylobacter, de certains Escherichia coli (E. coli) pouvant être pathogènes, ou des virus entériques humains tels que les norovirus qui sont connus pour être des agents responsables d’infections ou de toxi-infections alimentaires.
En 2021, 8,3 % des toxi-infections alimentaires collectives (TIAC) déclarées étaient dues à la consommation de coquillages. Les virus entériques ont été suspectés d’être responsables de 75 % de celles-ci.
Ces micro-organismes pathogènes sont souvent apportés aux eaux côtières par les rejets anthropiques en amont. Ils ont été par exemple retrouvés dans des zones côtières et leurs bassins versants en France.
Le risque de contamination des eaux côtières par ces micro-organismes pathogènes ne peut pas être estimé par leur recherche directe en raison de leur grande diversité, de leur présence souvent en faible nombre et du coût et du temps nécessaires pour ces analyses.
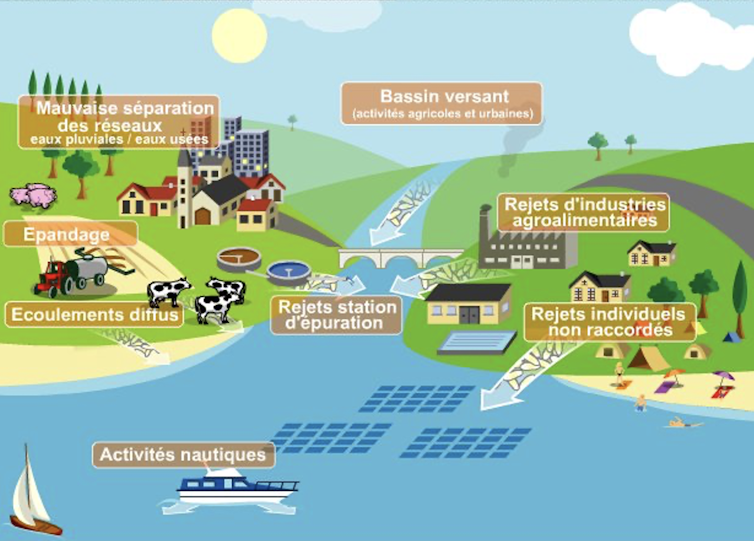
Les sources d’apports bactériens en zone côtière. Ifremer, Fourni par l'auteur
À la recherche des bactéries
Aussi, au niveau international, une alternative a été retenue pour évaluer la qualité sanitaire des eaux de surface et des lots de coquillages. Elle consiste à rechercher et quantifier des indicateurs bactériens de contamination fécale : les E. coli et les entérocoques intestinaux par culture, qui signent la présence d’une pollution fécale, et donc la possible présence de micro-organismes pathogènes.
Pour préserver la santé humaine, selon la réglementation européenne, le classement des zones de baignade (pendant la saison balnéaire), des zones conchylicoles (zones d’élevage des coquillages, suivies toute l’année) et des zones de pêche à pied repose sur la recherche et la quantification de ces indicateurs dans les eaux ou les coquillages.
Des concentrations élevées de ces indicateurs peuvent conduire à des déclassements ou fermetures de ces différentes zones et nécessiter une purification des coquillages des zones conchylicoles ou un reparcage de ceux-ci avant leur commercialisation.

Le classement des eaux de baignade en 2022 en Europe montre que la France est classée en 21ᵉ position si on prend en compte le paramètre "proportion des eaux classées en qualité excellente". Sur les 2074 zones de baignade en eau de mer et les 1296 en eau douce suivies en France, 77,9 % et 73,2 % des zones de baignade ont été respectivement classées en qualité excellente et 97,0 % et 89,3 % en qualité suffisante, avec une légère dégradation de la qualité sanitaire des eaux depuis 2019.
Identification des sources de contamination fécale
Dans un objectif d’amélioration de la qualité sanitaire des eaux et des coquillages, il est nécessaire de mettre en place des actions préventives et curatives pour limiter les pollutions d’origine fécale. Aussi, la discrimination et la hiérarchisation des sources de contamination sont devenues prioritaires.

Tables à huîtres dans une zone conchylicole. Aourégan Terre-Terrillon, Ifremer, Fourni par l'auteur
Pour identifier une pollution microbiologique et son origine, la première étape consiste à évaluer la contamination en E. coli des eaux et des coquillages de la zone concernée mais également plus en amont au niveau des eaux de rivières des bassins versants pouvant les impacter. La deuxième étape consiste à identifier la provenance de cet indicateur de contamination fécale.
Pour identifier les sources de ces bactéries, on utilise des méthodes regroupées sous le terme de Microbial Source Tracking (MST ou traçage des sources microbiennes, TSM).
À l’Ifremer, depuis 2005, nous avons retenu l’approche basée sur la recherche de marqueurs microbiologiques ciblant l’ADN de bactéries par amplification génique (la désormais célèbre PCR quantitative) et développé ou utilisé des marqueurs bactériens associés à une source de contamination précise : par exemple des marqueurs Porc, Ruminant (bovin et ovin), Oiseaux sauvages et même plus récemment Phoque.
À titre d’exemple, voici comment le marqueur Porc, dénommé Pig2Bac, a été développé. Il a été validé au niveau international et a été utilisé dans de nombreuses études aussi bien en France que dans d’autres pays.
Nous avons d’abord collecté un grand nombre de fèces et de lisiers de porcs dans des exploitations porcines en France. Nous en avons extrait l’ADN bactérien puis amplifié les séquences d’ADN correspondant aux bactéries de l’ordre des Bacteroidales, sélectionnées pour être des bactéries anaérobies majoritaires de la flore intestinale des animaux à sang chaud et des humains, pour certaines d’entre elles, spécifiques d’un hôte (ici, porcin) et ne se multipliant pas dans l’environnement.
Nous avons ensuite comparé ces séquences à d’autres séquences de bactéries du même ordre mais identifiées dans d’autres sources : humaines, bovines et aviaires.
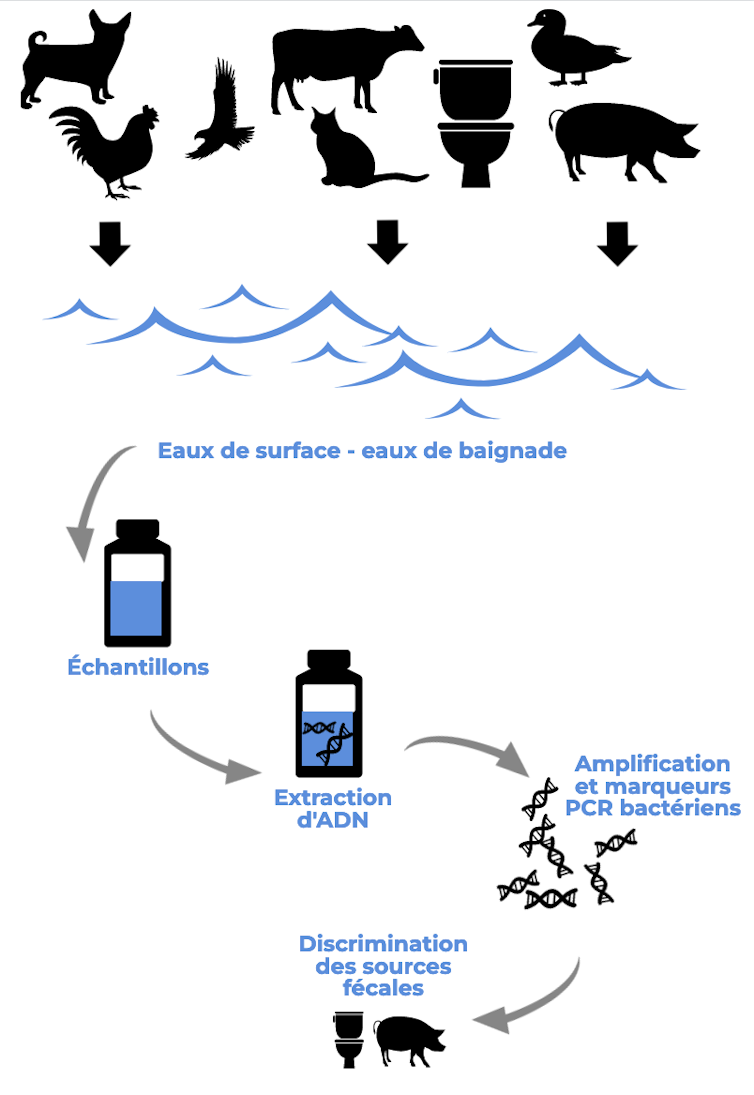
Méthode d’identification des sources de matières fécales grâce à des marqueurs génétiques. Sur cette illustration, à titre d’exemple, les sources de matières fécales identifiées à la dernière étape sont humaine et porcine. Michèle Gourmelon et Elsa Couderc, inspiré de Nshimyimana et coll., Water Research 2017, créé avec Piktochart, CC BY-SA
Des séquences de bactéries présentes spécifiquement chez les porcs ont ainsi été identifiées. Des amorces de PCR qui ciblent ces séquences ont ensuite été dessinées. Puis, nous avons vérifié que le marqueur Porc donnait des résultats positifs dans les échantillons d’origine porcine (évaluation de la sensibilité), et négatifs dans les échantillons d’autres origines (évaluation de la spécificité). Nous avons ainsi montré que ce marqueur avait une sensibilité de 100 % et une spécificité de 99 %. Ces très bons résultats ont donc permis de valider ce marqueur de contamination porcine.
Cependant, pour qu’un marqueur soit pertinent, il doit présenter une persistance dans les eaux, similaire à celle de l’indicateur E. coli. Nous avons donc suivi au laboratoire pendant plusieurs jours les concentrations du marqueur Pig2Bac et de E. coli dans une eau douce et une eau marine artificiellement contaminées par du lisier de porcs. Ce marqueur et d’autres que nous avons également testés persistaient généralement un peu moins longtemps dans les eaux que E. coli dénombré par culture : il ciblerait donc plutôt une contamination fécale récente. Toutefois, il est important de considérer que les conditions variables de température, salinité, oxygénation de l’eau ont une influence sur la persistance de ces bactéries et qu’il est difficile d’extrapoler ces résultats à une recherche dans l’environnement naturel.
Ce marqueur ainsi que ceux d’autres sources sont utilisés dans des études scientifiques et en routine par des laboratoires d’analyse des eaux pour répondre aux demandes des gestionnaires des eaux.
Pour être plus confiants dans les résultats d’identification des sources, on ne peut que recommander de rechercher en parallèle plusieurs cibles d’une même source et de différentes sources ; on parle dans ce cas de l’utilisation d’une "boite à outils TSM" ou MST-toolbox. Des marqueurs Bacteroidales et des composés chimiques, des stanols fécaux, ont ainsi donné des résultats intéressants lors d’un suivi sur plusieurs sites.
Les marqueurs mitochondriaux qui ciblent directement l’ADN de l’hôte, les virus entériques et certains bactériophages ou virus de bactéries, ainsi que les composés chimiques ingérés tels que la caféine et les médicaments en santé humaine ou vétérinaire peuvent aussi être utilisés.
De plus, on peut comparer des communautés bactériennes dans les sources et les eaux par des méthodes de séquençage haut débit.
L’approche Microbial Source Tracking continue à s’enrichir par la description et la validation de nouveaux marqueurs, ainsi que par l’intégration des derniers développements technologiques pour mieux cibler les agents recherchés. Ces développements et les intégrations de nouvelles méthodes ne peuvent qu’améliorer l’identification des sources de contamination fécale dans l’environnement et donc au final la qualité des eaux et des coquillages.
En conclusion, pour un bon usage des marqueurs et une identification correcte des sources, il est essentiel : de bien connaître la zone d’étude sur laquelle ils sont recherchés ; de prendre en compte l’influence des facteurs tels que la pluviométrie, qui peuvent aggraver les pollutions ; de remonter aux rivières identifiées comme pouvant impacter le site de baignade ou la zone conchylicole étudiés ; d’associer si possible plusieurs marqueurs complémentaires et de les rechercher dans plusieurs prélèvements d’un même site et dans les eaux en amont dans des conditions contrastées, plutôt que de réaliser une simple recherche ponctuelle peu discriminante.
Michèle Gourmelon, Microbiologiste, Ifremer
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.











